
一次聚焦,意义非凡。2026年2月7日,《人民日报》以其头版报道的黄金席位,为广东先康达生物科技有限公司(隶属于先康达集团,下称“广东先康达”)颁发了一张含金量极高的“国家名片”。在两会前夕这一政策风向标意义极强的时刻,此次报道已超越商业新闻本身,成为一项行业现象级事件。它向全社会宣告:先康达集团的技术创新与产业布局,正精准契合国家“十五五”规划的发展脉搏,站上了时代的风口。

一、细胞行业迎来“闭环时代”,政策助力提速发展
中国细胞行业历经二十余年发展,已逐步从科研探索迈入产业化、生态化发展的新阶段。特别是近十年,在政策、资本与技术的共同推动下,行业已进入构建全产业链、实现商业闭环的“快车道”,产业链各环节逐步打通,临床转化路径日益清晰。
2025年,在多项国家政策利好的推动下,细胞治疗与再生医学领域迎来爆发式增长。其中,2025年9月28日国务院发布的《生物医学新技术临床研究和临床转化应用管理条例》(即“818条例”),成为行业发展的关键转折点。该条例明确细胞项目的准入与转化路径,为行业提供了清晰的政策指引,显著加速细胞技术从实验室走向临床的进程。
二、直面行业核心痛点,“818条例”破局
任何新兴产业的爆发式增长,都源于对关键瓶颈的突破。细胞行业在迈向全面产业化的征程中,长期面临两大核心挑战,而国家政策的适时引导,正为企业指明了破局之道。
痛点一:细胞临床研究项目准入难
1. 审评路径不清:细胞产品介于“技术”与“药品”之间,分类与审评标准不明确。
2. 药学(CMC)门槛高:作为“活药物”,细胞产品的质量控制与工艺一致性把握难度大、成本高。
3. 双报批流程繁琐:需同时通过药监审批和医院伦理审查,周期长、协调难,影响项目推进效率。
痛点二:细胞项目转化应用闭环不畅
1. 规模化生产难:实验室小规模制备工艺难以直接放大至符合GMP标准的量产水平,成为技术转化的核心瓶颈。
2. 临床承接能力不足:细胞治疗需医疗机构具备相应治疗体系与风控能力,目前优质临床中心仍稀缺,难以匹配技术转化需求。
3. 支付体系不完善:细胞治疗作为创新疗法,依赖多元支付渠道支持,目前医保覆盖范围有限、商保衔接不足,导致治疗费用偏高,难以惠及广大患者。
“818条例”:吹响行业规范化、加速化的号角
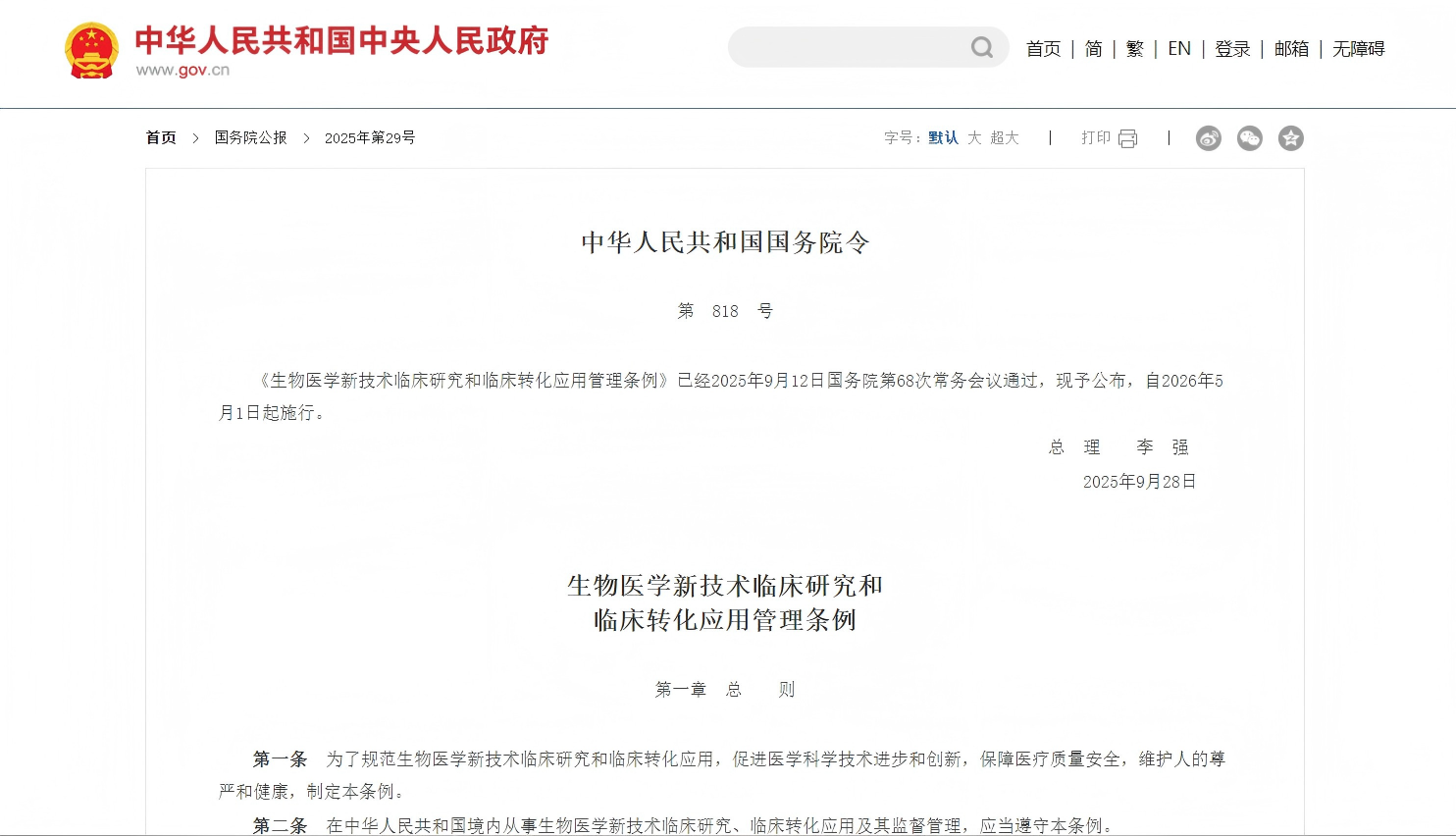
818条例的出台,正是针对上述痛点的“系统解决方案”。它标志着细胞行业监管进入一个更清晰、更高效、更系统的新阶段。
1. 清晰化:明确生物医学新技术的分类管理标准,细化项目申报流程与要求,为企业进行项目申报提供清晰的路径指引。
2. 高效化:优化审批流程、压缩审批周期,大幅缩短技术从科研到临床的落地时间,为优质项目的“准入”扫清障碍。
3. 系统化:强调临床研究与转化的全程监管,推动建立更加完善的产业链与生态圈。
2026年5月1日“818条例”正式实施后,将进一步推动项目落地与行业发展。
三、先康达顺势而为,成立生物医学新技术部,构建产业“加速器”
为积极响应政策导向、强化项目转化能力,先康达集团整合药物研发、技术开发、医学研究、自动化工程、培养基开发、实验室建设、市场推广等十大板块部门及分公司的核心人才力量,正式组建生物医学新技术部(筹)。

该部门由集团谢海涛董事长亲自牵头统筹,旨在打通“研发–中试–临床–产业化”全链条关键环节,推动细胞项目高效、合规落地。未来将重点承担项目立项评估、新技术转化推进等工作,推动细胞行业快速、专业、健康、有序发展。
四、展望未来:扎根广东,服务全国,迈向全球
2026年2月7日,《人民日报》在《广东力促服务业优质高效发展》专题报道中,开篇聚焦先康达集团。作为华南地区细胞领域的领先企业,先康达集团之所以能获此关注,背后是多年对技术创新的执着坚守、对产业闭环的不懈构建,以及对行业未来的坚定信念。
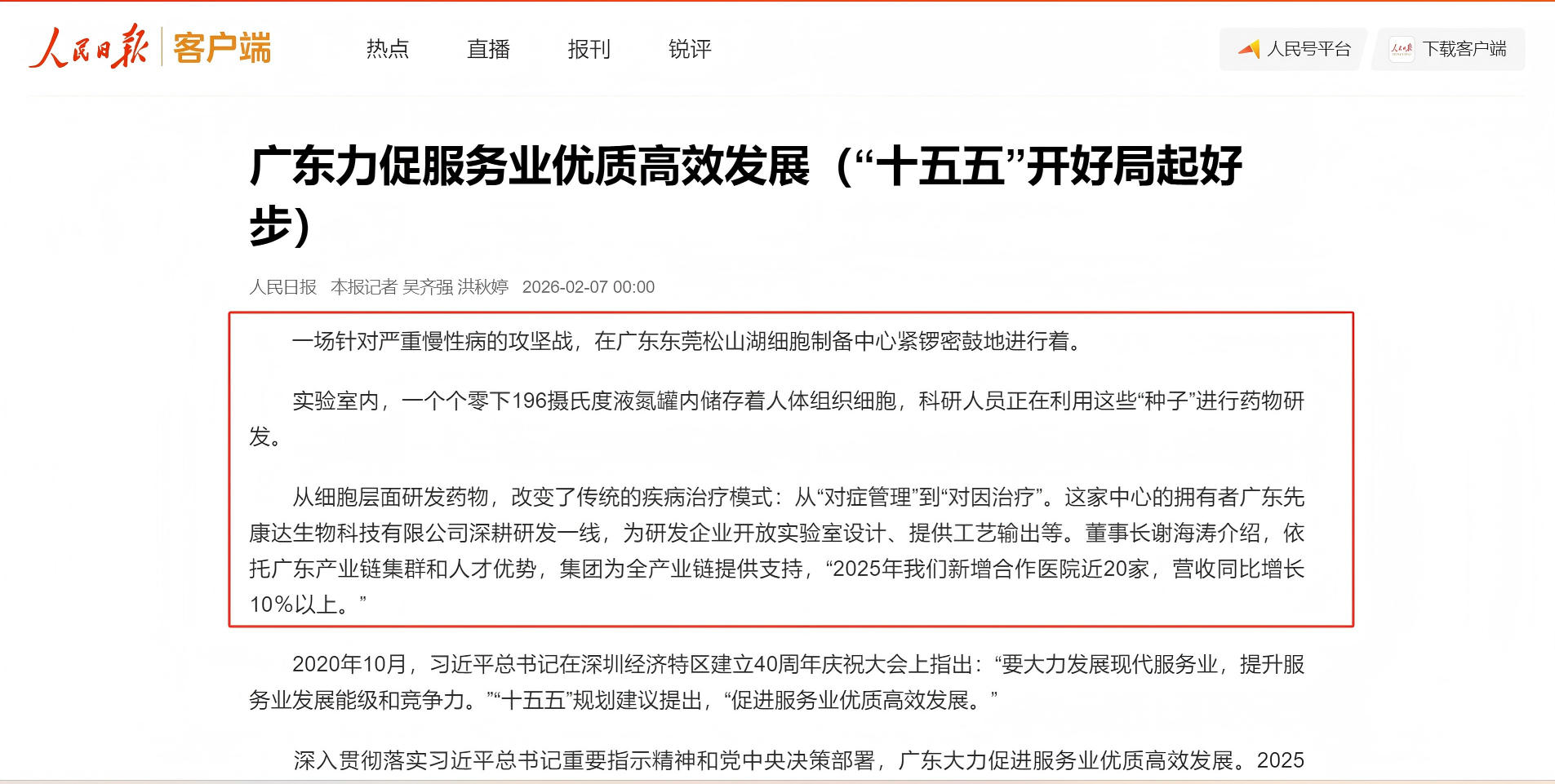
未来,先康达集团将继续紧跟“十五五”规划中关于“促进服务业优质高效发展”的指引,持续深化细胞治疗、再生医学等前沿技术布局,进一步强化与国内外医疗机构、科研单位、政府部门的协同创新,助力中国细胞科技跻身全球创新前沿。
五、结语
从一份细胞样本的存储,到一款新药的研发,再到一个产业的崛起——先康达始终坚信,科技的本质是服务于人,创新的使命是守护健康。站在政策与时代的交汇点,集团将继续以技术为舟、以使命为帆,在细胞治疗的蓝海中破浪前行。