
近日,广东先康达生物科技有限公司(隶属于先康达集团,以下简称“广东先康达”)自主研发的间充质干细胞外泌体成功通过美国食品药品监督管理局(FDA)的DMF备案,标志着集团的生产工艺与质量控制体系已获得国际权威认可。
依托CNAS认证的检测平台,确保外泌体质量符合高标准;干细胞制剂经中检院3大批9小批检测,实现源头可控;采用生物反应器进行规模化培养,最大50升规模3D培养,保障规模生产与批次稳定性;使用自主外泌体专用培养基,有效剔除外源外泌体干扰,进一步提升产品纯度与一致性。本次DMF备案的成功,彰显先康达外泌体具备三重认证(作为外泌体原料的干细胞通过中检院认证,质量检测平台通过CNAS认证,外泌体通过FDA的DMF备案)、源头可控、质量稳定,以及高纯度、高活性、高安全性等核心特点。

间充质干细胞外泌体(MSC-Exos)是从间充质干细胞培养上清液中分离纯化的细胞外囊泡(粒径 30~200nm),其表面阳性标志物为CD9、CD63、CD81、Alix、Tsg101,阴性标志物为Calnexin、histone 3,携带多种生长因子、miRNA及伤口愈合相关因子。相比间充质干细胞,其具有采集方便、无伦理争议、免疫原性更低等优势,是再生医学领域的新兴治疗工具。
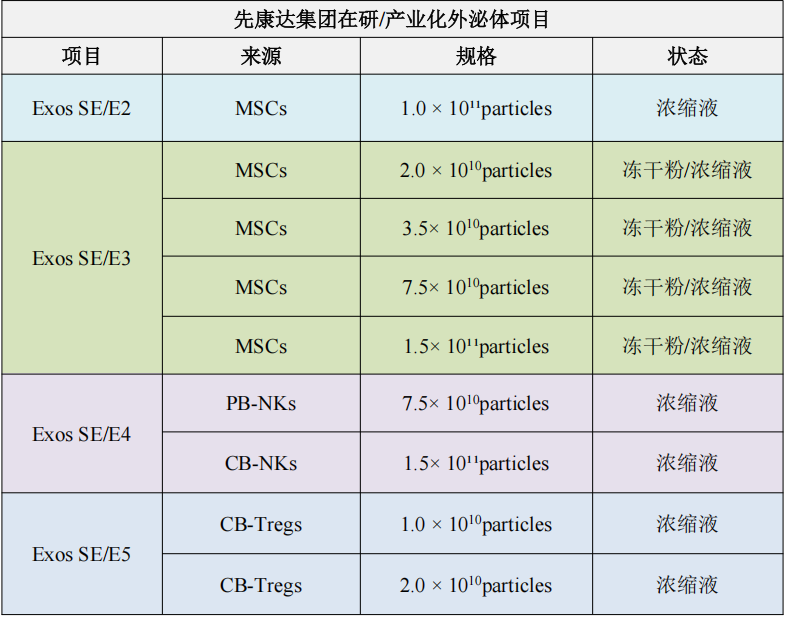
除间充质干细胞外泌体(MSC-Exos)外,集团依托现有技术优势,同步开发出外周血NK细胞、脐带血NK细胞、脐带血Treg细胞来源的外泌体,作为先进技术储备,为后续外泌体临床研究奠定基础。
此次DMF备案成功,是对先康达集团研发实力、技术创新、质量控制和生产能力的又一次认可,再次提升了其产品在国际市场上的竞争力与认可度。未来,集团将不断探索与突破,为全球生物医药领域带来更多高品质产品与解决方案。同时,也将继续加强与国内外科研机构和企业的深度合作与交流,共同推动生物医药技术的革新与发展。
关于DMF
DMF,全称Drug Master Files,是呈交FDA的存档待审资料,内容包含用于人体的药物产品在生产、加工、包装和储存过程中用到的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。FDA会对这些资料进行审核,以确保产品的安全性、质量和生产流程的合规性。