
6月10日,David Baker团队在国际顶尖学术期刊Cell上发表了题为“Modulation of FGF pathway signaling and vascular differentiation using designed oligomeric assemblies”的研究论文。该研究通过从头设计的环形蛋白质来调控成纤维细胞生长因子(FGF)信号通路和血管分化, 这种全新设计的蛋白质能够指导人类干细胞形成新血管,这种对干细胞发育的调控是朝着更有效的再生医学迈出的重要一步。

细胞表面受体聚集(Clustering)可以增强和维持对外源性信号的激活反应,因此人们对于调控受体聚集的技术颇感兴趣。此前曾利用天然存在的受体结合域来驱动受体聚集,并使用几何可调的二聚体配体来探究二聚化几何结构对信号输出的影响。更高阶的受体复合物被认为在多种信号传导系统中发挥作用;一个呈现受体结合域的可调节寡聚物支架将有助于研究纳米级拓扑结构对受体输出的影响。之前的设计工作产生了具有各种环形对称性的寡聚体,但这些蛋白质不易进行修改以产生不同的受体结合构象。
成纤维细胞生长因子受体(FGFR)是一种酪氨酸激酶,在胚胎发育和癌症中发挥着关键作用。该通路复杂且高度受调控,有四个FGFR基,以及两种由外显子8与外显子9的选择性剪接产生的异构体,这种选择性剪接改变了第三个免疫球蛋白样结构域(D3),生成了FGFR异构体IIIb和IIIc(简称b-异构体和c-异构体)。虽然D3是FGF结合区域的一部分,并且FGFR异构体对各种FGF配体的亲和力不同,但两种异构体对正常组织分化的贡献尚未完全阐明。c-异构体在许多实体瘤中发生扩增,因此可能是癌症治疗的靶点。
在这项最新研究中,研究团队描述了对几何可调的环状寡聚体的全新的从头设计,以克服当前支架系统存在的局限性,并使用这些合成支架与针对FGFR的c-异构体设计的特异性迷你结合剂一起,探究并操控血管分化。
为了系统地探索受体亲和力和几何结构对信号传递结果的影响,研究团队设计了使用可模块化扩展的重复蛋白构建块的环形同源寡聚体,其中包含多达8个亚基。通过将全新设计的成纤维细胞生长因子受体(FGFR)结合模块整合到这些寡聚体支架中,研究团队生成了一系列具有强大的亲和力和几何结构依赖性钙离子释放和MAPK通路激活的合成信号转导配体。
这些设计的激动剂的高特异性揭示了两种FGFR异构体(b-异构体、c-异构体)在早期血管发育期间驱动动脉内皮细胞和血管周围细胞命运中的不同作用。该研究设计的模块化组装体在揭示关键发育过渡中的复杂信号传递机制以及开发未来治疗应用方面具有广泛的用途。
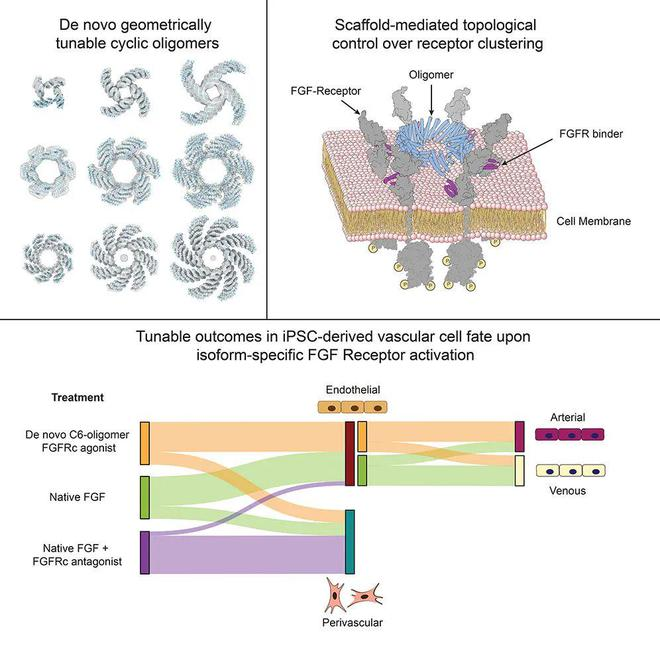
通俗来说,该研究从头设计了一类全新的环形蛋白质,能够靶向结合多达8个成纤维细胞生长因子受体(FGFR),通过改变环的大小和其他蛋白质的性质,可以控制干细胞在实验室条件下的成熟,能够形成功能性的和成熟的血管网,这些血管网可进一步形成管状结构,还能在划伤后愈合,并像预期的那样从周围环境中吸收养分。当移植到小鼠体内后,这些小型人体血管网在三周内就与小鼠循环系统建立了联系。
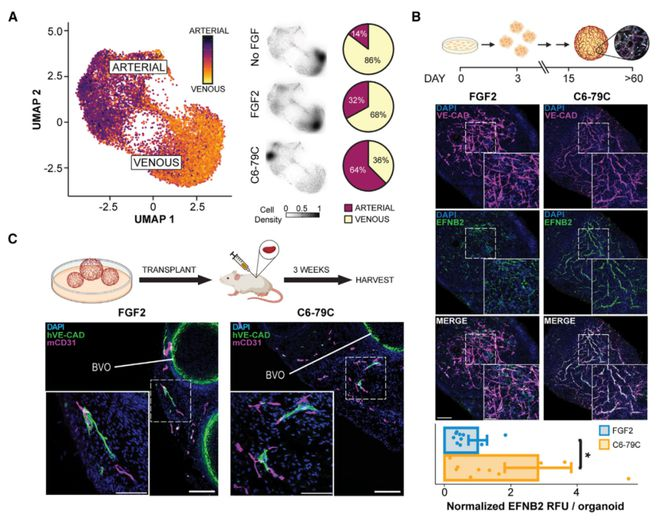
研究团队表示,该研究首次使用从头设计的蛋白质来指导干细胞成为形成动脉壁的内皮细胞,这一突破将帮助研究人员模拟相关疾病并再生血管。这项研究首先聚焦于构建血管网,但该技术还适用于许多其他类型的组织。这为研究组织发育开辟了一种新途径,并可能为脊髓损伤等目前没有好的治疗选择的疾病带来全新的治疗药物。